Diagnose
25. Mai 2021
Diagnose:
Multiple oberflächliche Pyodermata gangraenosa, mit dem klinischen Bild eines Sneddon-Wilkinson-Syndroms bei einem Patienten mit Colitis ulcerosa
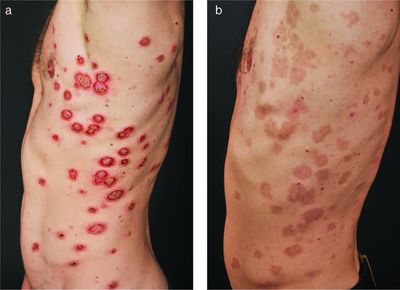
vor Einleitung der anti-TNFα Therapie
(a). Hautbild sechs Wochen nach
Einleitung der Anti-TNFα-Therapie (b).
Diskussion
Pyoderma gangraenosum (PG) ist eine seltene, schubweise auftretende neutrophile Dermatose, welche sich durch schmerzhafte, sterile, nekrotisierende Ulzera präsentiert. Es stellt eine der assoziierten Erkrankungen chronisch entzündlicher Darmerkrankungen dar und tritt bei 0,5–2,0 % der Betroffenen auf. Im Gegenzug leiden 36–50 % der Patienten mit PG an einer Darmerkrankung. Speziell die oberflächliche Form des PG kann diagnostisch und therapeutisch eine Herausforderung sein [1, 2]. Die Pathogenese des PG ist weitgehend unbekannt. Vermutet wird eine zugrundeliegende Immundysregulation die im Besonderen durch eine Dysfunktion neutrophiler Granulozyten mediiert wird [3]. Verschiedene Studien konnten zeigen, dass in PG-Läsionen Interleukin (IL)-1β, IL-8, IL-17, IL-23, Chemokine 1, 2, 3 und 16, Tumornekrosefaktor a
(TNFα), Metalloproteinasen (2 und 9) und Janus-Kinasen (JAK)-1, -2 und -3 überexprimiert sind. Darüber hinaus wurden bei Patienten mit PG erhöhte Serumspiegel von Granulozytenkolonie-stimulierendem-Faktor (G-CSF), TNF-α, IL-6, IL-8, löslichem IL-2-Rezeptor und Anti-Phosphatidylserin-Prothrombin-Komplex gemessen. Eine Abnahme dieser systemischen Entzündungsmarker kann mit einer klinischen Verbesserung der PG-Läsionen korrelieren [4–7]. Die Verfügbarkeit zahlreicher spezifischer Moleküle und Antikörper, um gezielt inflammatorische Mediatoren zu blockieren, hat die Therapiemöglichkeiten schwerer Formen des PG wesentlich erweitert.
Differenzialdiagnostisch kamen bei unserem Patienten mehrere Diagnosen in Frage: multiple Pyodermata gangraenosa, die subkorneale Pustulose (Sneddon Wilkinson) [8] und Erythema annulare centrifugum-artige Psoriasis. In Zusammenschau wies vor allem die Histologie sowie das Vorliegen einer chronisch entzündlichen Darmerkrankung bei unserem Patienten auf die Diagnose eines multilokulären Pyoderma gangraenosum hin. Angesichts der Schwere und der Progredienz der Hautläsionen wurde der Patient stationär aufgenommen und mit einer Stoßtherapie mit Prednisolon, beginnend mit 2 mg/kg Körpergewicht (KG) i.v. behandelt. Topisch kamen Kortikosteroide der Klasse IV sowie antiseptische Umschläge zur Anwendung. Diese Therapie war wirkungslos. Basierend auf zahlreichen Berichten über die Wirksamkeit von TNFα-Antikörpern bei PG-Patienten leiteten wir eine Therapie mit Infliximab (5 mg/kg KG) ein. Alternativ wurden auch andere immunsuppressive und immunmodulierende Behandlungen wie mit Ciclosporin, Mycophenolatmofetil, Dapson, Tacrolimus, und Thalidomid erwogen [9–11]. Aufgrund des günstigen Nebenwirkungsprofils, der Wirksamkeit bei entzündlichen Darmerkrankungen und in Antizipation der Notwendigkeit einer Dauertherapie entschlossen wir uns jedoch für eine TNFα-Blockade.
Bereits innerhalb weniger Tage nach Einleitung der Therapie berichtete der Patient über eine signifikante Verbesserung der gastrointestinalen Beschwerden: Die Häufigkeit der Durchfälle nahm rasch ab und die Bauchschmerzen verschwanden. Zudem sahen wir eine schnelle Verbesserung der Hautläsionen, die nach sechs Wochen vollständig abgeheilt waren und lediglich bräunliche Maculae im Sinne einer postinflammatorischen Hyperpigmentierung zurück ließen (Abbildung 2). Aktuell (März 2020) stellt sich der Patient alle acht Wochen in unserer Klinik zur Fortführung der intravenösen Infliximab-Therapie vor. Der Patient berichtet, dass die Colitis ulcerosa vollkommen symptomlos ist und die Hautläsionen vollständig abgeheilt sind. Infliximab ist ein chimärer monoklonaler Antikörper (mAb), der sowohl an membrangebundenes als auch an lösliches TNFα bindet [12]. Es ist das einzige Biologikum, welches in einer randomisierten, placebokontrollierten Doppelblindstudie zur Behandlung des Pyoderma gangraenosum untersucht wurde. Neunundsechzig Prozent der Patienten (n = 30), die Infliximab erhalten hatten, zeigten nach sechs Wochen eine Verbesserung ihres Zustands, sechs Patienten hatten eine vollständige Remission [13].
Infliximab wird vor allem zur Induktion und Aufrechterhaltung der Remission bei Patienten mit Colitis ulcerosa angewendet, bei denen die konventionelle Therapie versagt hat, die dauerhaft Glukokortikoide benötigen oder eine therapierefraktäre Erkrankung aufweisen [8].
Dieser Fall zeigt eindrücklich, dass sowohl die Beschwerden einer chronisch entzündlichen Darmerkrankung wie auch eine assoziierte Hauterkrankung erfolgreich mit systemischer TNFα-Blockade behandelt werden können. Daher sollte eine TNFα-Antikörper-Therapie vor allem bei Patienten mit Colitis ulcerosa und therapierefraktärem PG erwogen werden.
Interessenkonflikt
Keiner.
Literatur
1 McKenzie F, Cash D, Gupta A et al. Biologic and small-molecule medications in the management of pyoderma gangrenosum. J Dermatolog Treat 2019; 30(3): 264–76.
2 Al Ghazal P, Klode J, Dissemond J. Diagnostic criteria for pyoderma gangrenosum: results of a survey among dermatologic wound experts in Germany. J Dtsch Dermatol Ges 2014; 12(12): 1129–31.
3 McKenzie F, Gupta A, Cummings LW, Ortega-Loayza A. Biologic and small molecule medications in the management of pyoderma gangraenosum. J Dermatolog Treat 2019; 30(3): 264–76.
4 Marzano AV, Fanoni D, Antiga E et al. Expression of cytokines, chemokines and other effector molecules in two prototypic autoinflammatory skin diseases, pyoderma gangraenosum and Sweet’s syndrome. Clin Exp Immunol 2014; 178(1): 48–56.
5 Alves de Medeiros AK, Speeckaert R, Desmet E et al. JAK3 as an emerging target for topical treatment of inflammatory skin diseases. PLoS One 2016;11(10): e0164080.
6 Guenova E, Teske A, Fehrenbacher B et al. Interleukin 23 expression in pyoderma gangrenosum and targeted therapy with ustekinumab. Arch Dermatol 2011; 147(10): 1203–5.
7 Okuma K, Mitsuishi K, Hasegawa T et al. A case report of steroid and immunosuppressant-resistant pyoderma gangrenosum successfully treated by granulocytapheresis. Ther Apher Dial 2007; 11(5): 387–90.
8 Kretschmer L, Maul JT, Hofer T et al. Interruption of Sneddon-Wilkinson subcorneal pustulation with infliximab. Case Rep Dermatol 2017; 9(1): 140–4.
9 Herberger K, Dissemond J, Bruggestrat S et al. Biologics and immunoglobulins in the treatment of pyoderma gangrenosum – analysis of 52 patients. J Dtsch Dermatol Ges 2019; 17(1): 32–41.
10 Quist SR, Kraas L. Treatment options for pyoderma gangrenosum. J Dtsch Dermatol Ges 2017; 15(1): 34–40.
11 Al Ghazal P, Dissemond J. Therapy of pyoderma gangrenosum in Germany: results of a survey among wound experts. J Dtsch Dermatol Ges 2015; 13(4): 317–24.
12 Klotz U, Teml A, Schwab M. Clinical pharmacokinetics and use of infliximab. Clin Pharmacokinet 2007; 46(8): 645–60.
13 Brooklyn TN, Dunnill MG, Shetty A et al. Infliximab for the treatment of pyoderma gangrenosum: a randomised, double blind, placebo controlled trial. Gut 2005; 55(4): 505–9.
14 Rothfuss KS, Stange EF, Herrlinger K. Disseminated refractory pyoderma gangraenosum during an ulcerative colitis flare. Dermatol Case Rep 2015; 9(3): 62–6.

Die Diagnosequizze werden uns freundlicherweise zur Verfügung gestellt vom
"Journal der Deutschen Dermatologischen Gesellschaft" © Deutsche Dermatologische Gesellschaft
![Logo: Junge Dermatologen im Berufsverband der deutschen Dermatologen - zur Startseite [ALT+1]](/typo3conf/ext/judermconfig/Resources/Public/Images/Branding/JuDermLogo.png?v=2)